Faktor Ketersediaan Hara Dalam Tanah
-
Upload
habsari-utami -
Category
Documents
-
view
44 -
download
0
description
Transcript of Faktor Ketersediaan Hara Dalam Tanah
FAKTOR-FAKTOR KETERSEDIAAN HARA DALAM TANAH
Bahan kajian MK. Pupuk dan PemupukanDiabstraksikan olehProf Dr Ir Soemarno MSJur Tanah FP UB Oktober 2011
Ketersediaan hara bagi tanaman ditentukan oleh faktor-faktor yang mempengaruhi kemampuan tanah mensuplai hara dan faktor-faktor yang mempengaruhi kemampuan tanaman untuk menggunakan unsur hara yang disediakan. Tujuan dari uji-tanah adalah mengukur faktor-faktor ini dan menginterpretasikan hasil-hasilnya dalam konteks perlakuan penyembuhan yang mungkin diperlukan. Beberapa faktor dapat ditentukan melalui pekerjaan analisis laboratorium. Sedangkan faktor lainnya seperti kandungan oksigen-udara -tanah, suhu tanah dan lainnya, harus ditentukan di lapangan.
Dalam menyarankan suatu prosedur untuk mengukur ketersediaan unsur hara atau menginterpretasikan hasil-hasil pengukurannya, pengetahuan tentang berbagai reaksi yang berlangsung dan dialami oleh unsur hara dalam tanah sangat penting. Oleh karena itu dalam pembahasan kali ini akan dipusatkan pada faktor-faktor yang terlibat dengan suplai hara pada permukaan akar tanaman.
Sumber: www.fao.org/docrep/010/ag120e/AG120E10.htm
Faktor-faktor yang mempengaruhi konsentrasi larutan tanah
Unsur hara yang larut dalam larutan-tanah berasal dari beberapa sumber seperti pelapukan mineral primer, dekomposisi bahan organik, deposisi dari atmosfer, aplikasi pupuk, AIR IRIGASI, rembesan air tanah dari tempat lain, dan lainnya. Ion-ion nitrat dan khlorida sangat mudah larut dan lazimnya tidak membentuk senyawa yang tidak-larut dengan komponen tanah. Akibatnya nitrat dan khlorida yang ditambahkan ke tanah akan tetap berbentuk anion dalam larutan tanah hingga diserap oleh akar tanaman atau jasad renik, tercuci, atau mengalami reaksi denitrifikasi nitrat. Anion sulfat dalam tanah-tanah netral dan alkalis mempunyai perilaku yang serupa dengan nitrat, tetapi dalam tanah-tanah masam cenderung untuk dijerap oleh koloid tanah. Kebanyakan unsur hara lainnya membentuk beberapa tipe senyawa yang kurang melarut dan cenderung mempertahankan konsentrasi kesetimbangan dalam larutan tanah. Dengan demikian kation-kation larut air akan berkesetimbangan dengan kation tukar; kation-kation seperti Cu dan Zn mempunyai ciri-ciri asam Lewis (sebagai aseptor elektron) dapt membentuk kompleks dengan bahan organik tanah; ion ferri dan Al membentuk hidroksida atau oksida hidrous yang tidak melarut; fosfor membentuk senyawa Fe-fosfat, Al-fosfat dan Ca-fosfat yang tidak melarut.
Sumber: elkhorn.unl.edu/epublic/pages/publicationD.js...
Kemasaman Tanah (pH)
Kondisi pH tanah merupakan faktor penting yang menentukan kelarutan unsur yang cenderung berkesetimbangan dengan fase padatan. Kelarutan oksida-oksida hidrous dari Fe dan Al secara langsung tergantung pada konsentrasi hidroksil (OH-) dan menurun kalah pH meningkat. Kation hidrogen (H+) bersaing secara langsung dengan kation-kation asam Lewis lainnya membentuk tapak kompleksi, dan oleh karenanya kelarutan kation kompleks seperti Cu dan Zn akan meningkat dengan menurunnya pH. Konsentrasi kation hidrogen menentukan besarnya KTK tergantung-muatan (dependent charge) dan dengan demikian akan mempengaruhi aktivitas semua kation tukar. Kelarutan Fe-fosfat, Al-fosfat dan Ca-fosfat sangat tergantung pada pH, demikian juga kelarutan anion molibdat (MoO4) dan sulfat yang terjerap. Anion molibdat dan sulfat yang terjerap, dan fosfat yang terikat Ca kelarutannya akan menurun kalau pH meningkat. Selain itu, pH juga mengendalikan kelarutan karbonat dan silikat, mempengaruhi reaksi-reaksi redoks, aktivitas jasad renik, dan menentukan bentuk-bentuk kimia dari fosfat dan karbonat dalam larutan tanah. Pengasaman mineral silikat dapat menggeser "muatan patahan" dari negatif menjadi positif. Beberapa reaksi penting yang terpengaruh oleh pH.
Pengaruh pH tanah terhadap ketersediaan hara dalam tanah bagi tanaman. Pita lebar menyatakan bentuk hara elebih tersedia (lebih mudah diserap) oleh akar tanaman , pada berbagai nilai pH
Sumber: http://extension.missouri.edu/p/G9102
Penyerapan dan ketersediaan hara juga dipengaruhi oleh pH tanah. Sumber: http://www2.mcdaniel.edu/Biology/botf99/nutrition/soils.htm
Pengaruh kemasaman terhadap beberapa reaksi yang berlangsung dalam tanah
No.Gugusan yang ter-pengaruhi Reaksi-reaksi umum
1.Hidroksida dan xAl3+ + 3xOH- === AlxOH(3x-y)y+ + yOH- === xAl(OH)3
Oksida xFe3++ 3xOH- === FexOH(3x-y)y+ + yOH- ====
xFe(OH)3 === 0.5xFe2O3 + 3x H2O
2.Karbonat CaCO3 + 2H+ === Ca++ + CO2 + H2O
3.Kompleks*) CuCh + 2H+ === Cu++ + H2Ch
4.Fosfat Fe(OH) 2H2PO4 + OH- === Fe(OH) 3 + H2PO4-
Al(OH) 2H2 PO4 + OH- === Al(OH) 3 + H2PO4-
Ca10(PO4)6(OH) 2 +14H+ === 10Ca++ + 6H2PO4- + 2H2O
5.Silikat Mg2SiO4 + 4 H+ === 2Mg++ + Si(OH)4
SiO2 +H2O +OH- === OSi(OH) 3-
6.KTK (tergantung pH)M+X- + H+ === M+ + HX (**)
7.Muatan pada Si Si
patahan silikat O 0.5- + H+ === OH 0.5+
Al Al
Al-OH0.5- + H+ ==== Al-OH2 0.5+
8.Sistem redoks Mn2+ + H2O + O2 === 2 H+ + MnO2
2Fe2+ + 5 H2O + O2 === 4H+ + 2Fe(OH) 3
H2S + 2O2 === 2H+ + SO4=
NH4+ + 2O2 === 2 H+ + NO3- + H2O
9.Ion dalam HPO4= + H+ === H2PO4-
larutan H2CO3 === HCO3- + H+ === CO3= + 2 H+
Cu++ + OH- ==== CuOH+
Keterangan: *) Ch adalah khelat, mencerminkan elektron donor. (**) X merupakan tapak muatan yang tergantung pH, terutama karboksilat dan fenolat, M+ merupakan kation tukar.(a). denitrifikasi nitrat, kombinasi reaksi 1 dan 4(b). reduksi MnO2 menjadi Mn++, reaksi no. 5(c). reduksi Cu++ menjadi Cu+, reaksi no. 7(d). reduksi oksida hidrous Fe+++ menjadi Fe++, no. 8(e). reduksi SO4= menjadi H2S, reaksi no. 9(f). produksi CH4, reaksi no. 10(g). produksi H2, reaksi no. 12
pH tanah sangat berpengaruh terhadap ketersediaan hara dalam larutan tanah. Jumlah terbesar unsur hara esensial tersedia pada kisaran kondisi pH antara 5.2 dan 6.5. Di atas dan di bawah kisaran ini, sebagian hara terikat kuat oleh partikel tanah dan tidak tersedia bagi tanaman, misalnya Fe dan Mn. Unsur hara ini tampaknya akan deficient kalau pH tanah meningkat di atas 6.5. Pada kondisi pH lebih dari 8.0, sebagian besar unsure mikro menjadi defisien sedangkan Al mencapai tingkat toksik.
Diagram showing the availability of sixteen plant nutrients of various pH levels. Vertical lines at 5.2 and 6.5 indicate the desirable pH range for availability of all essential nutrients. Sumber: http://www.caes.uga.edu/departments/hort/extension/mastergardener/training/PlantPhysiologyFiles/plant%20physiology%20seg%207_files/textmostly/slide8.html
pH dan dinamika hara
Keseimbangan ammonia - ammonium
Dalam larutan tanah, gas ammonia terlarut (NH3) ternyata berkesetimbangan dengan kation ammonium (NH4+).
NH4+ ============= NH3 + H+
The ratio of NH4+ to NH3 in this equilibrium is highly pH dependent. At low pH (more acidic) the NH4+ form dominates, while at high pH (highly alkaline) there is more of the NH3 gas form. The proportions of NH3 and NH4+ are equal at a pH of 9.2.
Perilaku amonium dipengaruhi oleh kemasaman (pH). Distribution of ammonium / ammonia according to soil solution pH. Sumber: http://www.grdc.com.au/director/events/researchupdates?item_id=C78E39F79B4950C90E77BB1013190914
Ketersediaan Fosfat dalam Tanah dan pH
Ada tiga macam bentuk P dalam tanah, yaitu P-tanah, P-bahan organic, dan P-larutan tanah. The soil P and organic matter P forms are not available for plant use. The soil P must undergo a series of chemical reactions before it can enter the soil solution. Organic matter P must be mineralized by microorganisms before it becomes plant available. The P in soil solution is plant available; however, at any given time less than 1% of all the P in the soil is plant available in the soil solution. This makes leaching losses of P unlikely.
Akar tanaman menyerap fosfat dari larutan tanah dalam bentuk ion orthophosphate : HPO4-2 atau H2PO4-. The proportion in which these two forms are absorbed is determined by the soil pH, when at higher soil pH more HPO4-2 is taken up. The mobility of phosphorus in soil is very limited and therefore, plant roots can take up phosphorus only from their immediate surroundings. Since concentration of phosphorus in the soil solution is low, plants use mostly active uptake against the concentration gradient (i.e. concentration of phosphorus is higher in the roots compared with the soil solution). Active uptake is an energy consuming process, so conditions that inhibit root activity, such as low temperatures, excess of water etc., inhibit phosphorus uptake as well.
Sumber: http://www.smart-fertilizer.com/articles/phosphorus
Hubungan secara umum antara pH tanah dengan ketersediaan P dalam tanah , dibuat berdasarkan spesies senyawa fosfat pada berbagai nilai pH. Pada tanah dengan pH tinggi, kebanyakan P dalam bentuk senyawa kalsium. Pada tanah dengan pH rendah, P bersenyawa dengan Fe dan Al menjadi senyawa Fe dan senyawa Al. Keterseediaan P yang maksimum terjadi pada kondisi pH 6.5 - 7.0.
Spesies fosfat dalam tanah bergantung pada pH tanah. Sumber: http://passel.unl.edu/pages/informationmodule.php?idinformationmodule=1130447043&topicorder=3&maxto=15&minto=1
Perilaku Al dalam Tanah
Kelarutan Al menurun dengan drastic dengan meningkatnya pH tanah, dan konsentrasi monomeric Al anorganik dalam laruitan tanah juga dipengaruhi oleh adanya anion organim dan anorganik. pH tanah mempengaruhi kelarutan Al, dan spesiasi Al dalam larutan tanah juga berubah dengan pH. Pada kondisi pH = 4.0, sebagian besar monomeric Al anorganik berbentuk Al3+; spesies ini menurun dengan meningkatnya pH sedangkan aktivitas spesies Al hidroksi (AlOH2+, Al(OH)2+) mengalami peningkatan. Pada kondisi pH alkalis, ion-ion aluminate (e.g. Al(OH)4, Al(OH)52) masuk ke dalam larutan tetapi tidak toksik bagi akar tanaman (Kinraide 1990).Al terlarut dalam larutan tanah sangat berpengaruh cepat terhadap pertumbuhan akar tanaman, dampaknya sering tampak dalam waktu dua hari. Secara mikroskopis , penurunan pertumbuhan akar dapat terlihat dalam waktu beberapa jam paparan Al, dan perubahan aktivitas Golgi apparatus terjadi dalam periode 5 jam penempatan akar dalam larutan yang mengandung Al. Untuk bersifat toksik, ujung akar harus terpapar Al (Ryan et al. 1993).
(a) Total concentration of all ionic species of Al in solution as a function of pH. (b) A solution that initially contains 1000 M CaCl2 and 100M AlCl3 (used to approximate a soil solution) shows a marked decrease in concentration of Al3+ from pH 4.0 to pH 6.0, and a change in relative activities of different inorganic monomeric Al species. Underlying equilibria responsible for such pH effects are summarised below. Values for pK coincide with the pH of a solution where the reaction mixture would be 50% dissociated. Increasing H+ ion concentration due to decreasing pH forces such equilibria towards Al3+, thus inducing Al toxicity.Al3+ + H2O AlOH2+ +H+ pK = 5.00Al3+ + 2H2O AlOH2+ +2H+ pK = 10.10(Based on Kinraide 1990)Sumber: http://plantsinaction.science.uq.edu.au/edition1/?q=content/16-5-2-aluminium-and-manganese-toxicities
Pertumbuhan akar kedelai menurun tajam dengan adanya peningkatan aktivitas Al monomerik dalam larutan tanah. (Alva et al. 1986). Sumber: http://plantsinaction.science.uq.edu.au/edition1/?q=content/16-5-2-aluminium-and-manganese-toxicities.
Potensial Redoks (Eh)
Faktor lain yang sangat penting dalam menentukan konsentrasi hara dalam larutan tanah adalah potensial redoks (Eh). Faktor ini berhubungan dengan keadaan aerasi tanah yang selanjutnya sangat tergantung pada laju respirasi jasad renik dan laju difusi oksigen. Ia mempengaruhi kelarutan unsur hara mineral yang mempunyai lebih dari satu bilangan oksidasi (valensi). Unsur-unsur ini adalah C, H, O, N, S, Fe, Mn, dan Cu. Kandungan air yang mendekati atau melebihi kondisi ke-jenuhan merupakan sebab utama dari buruknya aerasi karena kecepatan difusi oksigen melalui pori yang terisi air jauh lebih lambat daripada pori yang berisi udara.
Potensial redoks pada kondisi tanah tergenang dan aktivitas ion. Example of the range in redox potential in soils and the location in the redox range where the various electron acceptors are active (R. W. Miller, 1981) . Sumber: http://www.soils.wisc.edu/courses/SS325/oxides.htmA high redox potential equals to well-aerated environmental conditions and a low redox potential equals to saturated environmental conditions. Saturated soils become depleted of oxygen, because this is rapidly consumed by aerobic organisms and cannot be replenished by diffusion quickly. Then, anaerobic and facultative organisms continue the decomposition process. In the absence of oxygen, other electron acceptors begin to function, depending on their tendency to accept electrons. When flooding occurs the reduction of the remaining oxygen will take place first, followed by the reduction of nitrate, then manganese, iron, sulphate, and carbon dioxide. The reduction of oxygen occurs by the O2 consumption of aerobic organisms, NO3- serves as a biochemical electron acceptor involving N-organisms that ultimately excrete reduced N, the reduction of Mn can be initiated in presence of NO3-, whereas the reduction of Fe cannot be initiated in presence of NO3-, and sulfate reducing bacteria are involved to reduce SO42-. (Schwertmann U., 1985. The Effect of Pedogenic Environments on Iron Oxides Minerals. In: Advances in Soil Science, Vol. 1, Springer-Verlag, New York, Inc.).
Diagram Eh-pH
Diagram stabilitas Eh-pH untuk berbagai spesies oksida besi dan hidroksida besi merupakan contoh yang bagus. Diagram ini dapat digunakan untuk memprediksi spesies besi apa yang direduksi atau yang dioksidasi. Reduksi atau oksidasi memang dapat terjadi di luar batas-batas ini, tetapi hanya mungkin kalau dimediasi oleh organism dengan menggunakan energy metabolik.
Oksida dan Hidroksida Besi
Iron oxides and hydroxides are very stable under aerobic conditions, but they become more soluble under anaerobic conditions (low redox potentials). They are able to form metal-organic complexes, where the metal cations are bonded by functional groups such as -COOH, =CO, -OH, -OCH3, -NH2, -SH to organic compounds resulting in the formation of a ring structure incorporating the metal ion. These complexes are very stable and called chelates.
Eh-pH stability diagram for iron oxides and hydroxides (Scheffer F., and Schachtschabel P. 1989. Lehrbuch der Bodenkunde. Enke Verlag, Stuttgart. Sumber: http://www.soils.wisc.edu/courses/SS325/oxides.htm
Oksida dan Hidroksida Mn
The weathering of primary minerals, such as biotite, pyroxene, amphibole, containing Mn2+, produce in an aerobic environment brown/black Mn4+. The reaction can be written as:
Mn2+ + H2O = MnO2 + 4H+ + 2e-
The pyrolusite (MnO2) is a very stable manganese oxide. Often manganese is associated with other ions such as Ba, Ca, K, Na, Li, NH4, Co, Cu and Ni, therefore the manganese oxides and hydroxides have variable forms. For example, birnessite (Na,Ca,K,Mg,Mn2+)Mn64+O14*H2O, lithiophorite (LiAl2Mn2+Mn24+O9*3H2O), or hollandite (BaMn8O16). Manganese oxides show even a greater tendency than iron oxides to occur in concretions. A reason might be the reduction of Mn4+ to Mn2+, which is relatively soluble, more readily soluble than for example Fe2+. Manganese-rich micromorphological zones in peds that are black, often also contain large amounts of iron oxides. However, iron-rich concretions have been shown to be low in manganese oxides. Manganese oxide minerals have a black color, which is sometimes difficult to distinct from the black color or organic material.
Eh-pH stability diagram for manganese oxides and hydroxides. (Scheffer F., and Schachtschabel P. 1989. Lehrbuch der Bodenkunde. Enke Verlag, Stuttgart. Sumber: http://www.soils.wisc.edu/courses/SS325/oxides.htm
Ikhtisar beberapa reaksi redoks yang penting disajikan berikut ini. Informasi dalam tabel ini menyatakan bahwa kalau tanah yang semula dalam kondisi oksidasi menjadi lebih reduksi mka akan dapat terjadi reaksi-reaksi berikut.
Beberapa reaksi oksidasi-reduksi yang penting dalam tanah
No. Eh (mV) Reaksi
1. 968 2NO3- + 8H+ + 6e N2 + 4 H2O
2. 815 O2 + 4H+ + 4e 2H2O
3. 771 Fe3+ + e Fe++
4. 421 NO3- + 2H+ + 2e NO2- + H2O
5. 401 MnO2 + 4H+ + 2e Mn++ + 2 H2O
6. 345 NO2- + 8H+ + 6e NH4+ + 2 H2O
07. -135 Cu++ + e Cu+
8. -185 Fe(OH)3 + 3H+ + e Fe++ + 3 H2O
9. -214 SO4= + 10H+ + 8e H2S + 4H2O
10. -245 CO2 + 8H+ + 8e CH4 + 2 H2O
11. -278 N2 + 8H+ + 6e 2NH4+
12. -414 2H+ + 2e H2
Sumber: Garrels dan Christ (1965)
Reaksi-reaksi lainnya berhubungan dengan batas atas stabilitas air (reaksi No.2), nisbah Fe+++ dengan Fe++ dalam larutan tanah (reaksi No.3), proses nitrifikasi (reaksi No.4 dan 6), dan proses fiksasi nitrogen (reaksi No.11). Denitrifikasi dan reduksi Mn masih dapat berlangsung dalam tanah yang basah tetapi tidak jenuh air. Reaksi lainnya umumnya memerlukan kondisi jenuh dan tergenang. Reduksi feri-oksida akan menghasilkan pelepasan fosfat yang terfiksasi oleh oksida, yang dapat memberikan sumbangan kepada nutrisi tanaman seperti padi yang dapat tumbuh pada kondisi tergenang. Potensial baku (Eh) hanya menjelaskan apa yang mungkin terjadi secara termodinamika. Laju aktual dari reaksi sangat tergantung pada sistem ensim jasad renik. Akan tetapi pentingnya pengaruh potensial redoks tanah terhadap komposisi larutan tanah sangatlah jelas.
Muatan Permukaan dan Pertukaran Kation
Partikel koloid tanah, seperti mineral liat aluminosilikat, mempunyai muatan negative di permukaannya. Muatan negative inilah yang mampu menahan kation dalam bentuk kation tukar (kation dapat ditukar). Besarnya muatan negative ini selanjutnya dapat dinyatakan dengan nilai KTK tanah, biasanya tanah-tanah liat mempunyai nilai KTK lebih besar dibandingkan tanah-tanah pasir.
Sumber: http://www.terragis.bees.unsw.edu.au/terraGIS_soil/sp_exchangeable_sodium_percentage.html
.Soil is made up of many components. A significant percentage of most soil is clay. Organic matter, while a small percentage of most soil is also important for several reasons. Both of these soil fractions have a large number of negative charges on their surface, thus they attract cation elements and contribute to a higher CEC. At the same time, they also repel anion nutrients ("like" charges).Larger CEC values indicate that a soil has a greater capacity to hold cations. Therefore, it requires higher rates of fertilizer or lime to change a high CEC soil. When a high CEC soil has good test levels, it offers a large nutrient reserve. However, when it is poor, it can take a large amount of fertilizer or lime to correct that soil test. A high CEC soil requires a higher soil cation level, or soil test, to provide adequate crop nutrition. Low CEC soils hold fewer nutrients, and will likely be subject to leaching of mobile "anion" nutrients. These soils may benefit from split applications of several nutrients. The particular CEC of a soil is neither good nor bad, but knowing it is a valuable management tool.Sumber: http://www.spectrumanalytic.com/support/library/ff/CEC_BpH_and_percent_sat.htm
KTK tanah merupakan ukuran banyaknya titik-titik pada permukaan partikel tanah yang dapat menahan kation dnegan ikatan elektrostatika. Kation-kation yang ditahan secara elektrostatika ini dapat dengan mudah ditukar oleh kation lain yang ada dalam larutan tanah, sehingga mudah dapat diserap oleh akar tanaman.
Kation-kation yang ditahan di permukaan koloid tanah (misalnya kation Ca++) dapat ditukar dengan H+ yang ada dalam alrutan tanah. Sumber: http://www2.mcdaniel.edu/Biology/botf99/nutrition/soils.htm
Penyerapan ion oleh akar tanaman dapat melalui proses-proses fifusi, aliran masa, dan pertukaran ion. Sumber: http://www2.mcdaniel.edu/Biology/botf99/nutrition/soils.htm
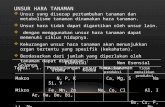
CEC is important for maintaining adequate quantities of plant available calcium (Ca2+), magnesium (Mg2+) and potassium (K+) in soils. Under acid conditions (pH Ca+2 = Mg+2 > K+ = NH4+ > Na+
In the case of cations with the same charge or valence the order of preference follows the order of decreasing hydrated radii:
K+ > Na+ > Li+
The greater the charge the greater the force of attraction and the greater the distance between the charges the lesser the force of attraction. In highly weathered soils such as the Southeastern USA and the tropics the high rainfall leaches monovalent and divalent cations and the exchange complex becomes dominated by Al+3 (low base saturation).Cation exchange sites are found primarily on clay and organic matter (OM) surfaces. Soil OM will develop a greater CEC at near-neutral pH than under acidic conditions. Additions of an organic material will likely increase a soil's CEC. Soil CEC may also decrease with time through acidification and OM decomposition. When a plant respires ( as well as other critters including fungi/bacteria in the soil) it releases CO2 which can then combine with soil water to produce H2CO3 --> dissociates into
H+ + HCO3 --> H+ and CO3.
The H+ displace the + charged minerals releasing them into soil solutions which can then be picked up by the root.
Pertukaran ion antara partikel koloid tanah dengan bulu akar tanaman.Both cations and anions have a tendency to get adsorbed on the surfaces of the cell walls, and exchange with ions present in the soil solution. This process of exchange between the adsorbed ions and ions in solution is known as ion exchange.Sumber: http://www.tutorvista.com/content/biology/biology-iv/plant-nutrition/passive-absorption.php
Pertukaran kation antara partikel tanah dengan akar tanaman. Clay soils are usually alkaline and bind positively charged minerals (cations such as Ca2+). Hydrogen ions (H+) help make nutrients available by displacing the cations. Plants secreting H+ by cellular respiration: CO2 reacts with H2O to form carbonic acid (H2CO3) in the soil, which dissociates to add H+ to the soil.
Sumber: http://bio1903.nicerweb.com/Locked/media/ch37/soil_availability.html
SISTEM RIZOSFER - TANAHThe rhizosphere concept was first introduced by Hiltner in 1904 to describe the narrow zone of soil surrounding the roots where microbe populations are stimulated by root activities. It thus distinguishes from the "bulk" soil, which is not influenced directly by growing roots. The original concept has now been extended to include the soil surrounding a root in which physical, chemical and biological properties have been changed by root growth and activity (McCully 2005).By definition, the rhizosphere is the volume of a thin layer of soil immediately surrounding plant roots that is an extremely important and active area for root activity and metabolism. Important physiological processes in this zone are the uptake of mineral nutrients and microbial activity enhanced by root exudates; it is profoundly different from the bulk soil.
Components That Relate to Nutrient Availability in the Soil- Rhizosphere System. Sumber: http://www.agnet.org/library.php?func=view&id=20110804155426&type_id=4
ROOT AND RHIZOSPHERE: SOIL INFLUENCED BY PLANT ROOTS
The Rhizosphere is the zone surrounding the roots of plants in which complex relations exist among the plant, the soil microorganisms and the soil itself. The plant roots and the biofilm associated with them can profoundly, influence the chemistry of the soil including pH and nitrogen transformations.
Sumber: Raina Maier et al., 2000, Environmental Microbiology. http://biology.kenyon.edu/courses/biol272/agriculture/agriculture.htm
NODULATION FOR NITROGEN FIXATION
Nodulasi untuk fiksasi nitrogen. Sumber: Raina Maier et al., 2000, Environmental Microbiology. http://biology.kenyon.edu/courses/biol272/agriculture/agriculture.htm
MIKORHIZA
Mikoriza adalah kelompok fungi (jamur) yang bersimbiosis dengan tumbuhan tingkat tinggi (tumbuhan berpembuluh, Tracheophyta), khususnya pada sistem perakaran. Terdapat juga fungi yang bersimbiosis dengan fungi lainnya, tetapi sebutan mikoriza biasanya adalah untuk mereka yang menginfeksi akar. Mikoriza memerlukan akar tumbuhan untuk melengkapi daur hidupnya. Sebaliknya, beberapa tumbuhan bahkan ada yang tergantung pertumbuhannya dengan mikoriza. Beberapa jenis tumbuhan tidak tumbuh atau terhambat pertumbuhannya tanpa kehadiran mikoriza di akarnya. Sebagai misalnya, semaian pinus biasanya gagal tumbuh setelah pemindahan apabila tidak terbentuk jaringan mikoriza di sekitar akarnya. Hanya sedikit kelompok tumbuhan yang tidak menjadi simbion, seperti dari Brassicaceae, Commelinaceae, Juncaceae, Proteaceae, Capparaceae, Cyperaceae, Polygonaceae, Resedaceae, Urticaceae, dan Caryophyllales. Mikoriza dapat diinokulasi secara buatan. Namun demikian, inokulasi mikoriza komersial memerlukan bantuan mikoriza lokal, misalnya dengan menambahkan tanah dari tempat asal tumbuhan (http://id.wikipedia.org/wiki/Mikoriza. SUMBER: Diktat perkuliahan "Mikorisa" oleh Siti Kabirun.).
Endomikorhiza. Sumber: Raina Maier et al., 2000, Environmental Microbiology. http://biology.kenyon.edu/courses/biol272/agriculture/agriculture.htm
Ektomikorhiza. Sumber: Raina Maier et al., 2000, Environmental Microbiology. http://biology.kenyon.edu/courses/biol272/agriculture/agriculture.htm
Siti Kabirun (2011) mengelompokkan mikoriza menjadi dua berdasarkan cara menginfeksinya, yaitu ektomikoriza dan endomikoriza.
EktomikorizaEktomikoriza menginfeksi permukaan luar tanaman dan di antara sel-sel ujung akar. Akibat serangannya, terlihat jalinan miselia berwarna putih pada bagian rambut-rambut akar, dikenal sebagai hartig net. Serangan ini dapat menyebabkan perubahan morfologi akar. Akar-akar memendek, membengkak, bercabang dikotom, dan dapat membentuk pigmen. Infektivitas tergantung isolat dan kultivar tumbuhan inang. Tumbuhan inangnya biasanya tumbuhan tahunan atau pohon. Beberapa di antaranya merupakan komoditi kehutanan dan pertanian seperti sengon, jati, serta beberapa tanaman buah seperti mangga, rambutan, dan jeruk. Selain itu pohon-pohon anggota Betulaceae, Fagaceae, dan Pinaceae juga menjadi inangnya. Pada umumnya ektomikoriza termasuk dalam Basidiomycota.
EndomikorizaEndomikoriza menginfeksi bagian dalam akar, di dalam dan di antara sel-sel ujung akar (root tip). Hifa masuk ke dalam sel atau mengisi ruang-ruang antarsel. Jenis mikoriza ini banyak ditemukan pada tumbuhan semusim yang merupakan komoditi pertanian penting, seperti kacang-kacangan, padi, jagung, beberapa jenis sayuran dan tanaman hias. Infeksi ini tidak menyebabkan perubahan morfologi akar, tetapi mengubah penampilan sel dan jaringan akar. Berdasarkan tipe infeksinya, dikenal tiga kelompok endomikoriza: ericaceous (Ericales dengan sejumlah Ascomycota), orchidaceous (Orchidaceae dengan sekelompok Basidiomycota), dan vesikular arbuskular (sejumlah tumbuhan berpembuluh dengan Endogonales, membentuk struktur vesikula (gelembung) dan arbuskula dalam korteks akar) disingkat MVA.
Mikoriza vesikular-arbuskular (MVA = VAM)MVA dan ektomikoriza berguna bagi pertanian dan kehutanan. Ektomokoriza dapat ditumbuhkan secara aksenik di laboratorium sehingga mudah dikembangkan. MVA sulit ditumbuhkan secara aksenik (media buatan) sehingga MVA dianggap merupakan simbion obligat (wajib). Vesikula berbentuk butiran-butiran di dalam sitoplasma yang mengandung lipid dan menjadi alat reproduksi vegetatif mikoriza, khususnya bila sel pecah akibat rusaknya korteks akar. Arbuskula berwujud kumpulan hifa yang menembus plasmalema dan membantu transportasi hara di dalam sel tumbuhan. Pembentukan vesikula dan arbuskula dalam sel menunjukkan bahwa simbiosis telah terjadi dengan sempurna dan tanaman sudah dapat menikmati hasil kerja sama dengan mikoriza berupa meningkatnya ketersediaan unsur hara yang diserap dari dalam tanah. Selain vesikula dan arbuskula, terbentuk hifa eksternal yang dapat membantu memperluas ruang penyerapan hara oleh akar. Pada bawang merah, misalnya, panjang hifa eksternal dapat mencapai 80 cm per satu cm panjang akar. Di luar akar, hifa dapat membentuk sporangium yang menghasilkan spora sebagai alat reproduksi.
Sumber: http://id.wikipedia.org/wiki/Berkas:Arbuscular_mycorrhiza_cross-section.png
Mikorhiza menembus di antara sel-sel dan memasuki sel
In this arrangement, specialized fungal hyphae form organs called mycorrhizae along the plants roots. The plants provide energy to the fungus, and the growing fungus produce enzymes that convert (chelate) organic material into minerals that are easy for the plant to absorb. The fungus also acts as a moist cushion against heat and drought. The fungus exudes antibiotics that protect roots from disease, and the action of the fungus protect the plant against toxicites in the soil as well. Sumber: Beneficial Mycorrhizae -Your Plants Best Friend. http://www.jasons-indoor-guide-to-organic-and-hydroponics-gardening.com/beneficial-mycorrhizae.html
MVA banyak membawa keuntungan bagi tumbuhan simbionnya. Ia memperbaiki hasil tumbuhan dan mengurangi masukan pupuk pada tanaman pertanian. Ini terjadi karena MVA meningkatkan ketersediaan beberapa hara di tanah yang diperlukan tanaman, terutama fosfat. Peningkatan penyerapan fosfat diiringi dengan peningkatan penyerapan hara lain, seperti nitrogen (N), seng (Zn), tembaga (Cu), dan belerang (S). Selain itu, MVA memperluas ruang tanah yang dapat dijangkau oleh tanaman inang. Jeruk, umpamanya, dikenal responsif terhadap inokulasi MVA. Inokulasi ini dapat mengarah pada menurunnya penggunaan pupuk P. Selain meningkatkan ketersediaan hara, MVA meningkatkan toleransi tumbuhan terhadap kurangnya pasokan air. Luasnya jaringan hifa di tanah membantu akar menyerap air. MVA memengaruhi ketahanan tumbuhan inang terhadap serangan penyakit. MVA, tergantung jenisnya, dapat mengurangi pengaruh serangan jamur patogen. Demikian pula, juga dapat mengurangi serangan nematoda. Sebaliknya, tumbuhan yang terinfeksi MVA menurun ketahanannya terhadap serangan virus.
Mikoriza membantu akar tanaman menyerap fosfat dari dalam tanah.
Mycorrihizal roots lack root hairs. The fungal sheath together with the hyphae extending to the soil absorb nutrients. The Hartig net acts as a liaison tissue between the fungal sheath and the host cells. The ectmycorrhizal habit increases the surface area of theroot system and hence affords better intake of nutrients such as nitrogen, phosphorus and potassium from the surrounding soil. Using intact plants as well as excised roots of pine (Pinus radiata) many workers have demonstrated the transfer of isotopically labelled phosphorus, nitrogen, calcium and sodium from the, soil into the roots through the fungal mycelium. The labelled isotopes were detected in all parts of the plants including leaves (http://www.planthealthsolutions.com.au/mycorrhizal-fungi-4178).).
Keterangan: 1. Root hairs; 2. Root surface; 3. Cortex; 4. Stele; 5. Arbuscle; 6. Hyphal coil; 7. Vesicle; 8. Distributive hyphae; 9. Diffusion path of phosphate ions; 10. Soil Particles; 11. Phosphate depletion zone; 12. AM hyphae in soil by-pass the phosphate depletion zone; 13. Absorbed and translocated by AM hyphae; 14. Appressorium; 15. Small Secondary Spores; 16. Large Resting SporeSumber: http://www.planthealthsolutions.com.au/mycorrhizal-fungi-4178.
The pattern of movement of ions has been investigated in ectomycorrhizae of Fagus sylvatica. The mycorrhizal association of this large rooted species can easily be distinguished into an outer fungal sheath and an inner host core. The host core consists of the Hartig net of the fungus between cells of the host. Experiments done by Harleyand his associates in England with excised mycorrhizal roots have shown that 80-90% of the absorbed phosphate remains accumulated in the fungal sheath whereas experiments done by Melin and Nilsson in Sweden with intact as well decapitated plants have, however, shown that accumulation of phosphate in the sheath is variable depending on the rates of transpiration since decapitated plants accumulated more of phosphates in the sheath the intact ones. It is likely that the sheath acts as a phosphate reservoir and releases the nutrient during certain deficiency conditions while under normal conditions, a steady uptake of phosphate to the plants is maintained by the fungal hyphae. (http://www.planthealthsolutions.com.au/mycorrhizal-fungi-4178).
Despite inverted relative dimensions of macro- and microsymbiont the interface and nutrient exchange in the G. pyriformis symbiosis correspond to that in the arbuscular mycorrhiza. Several arbuscular mycorrhiza-specific phosphate transporters (PT) are known from plants. The hypothetical role of GpMST1, and its orthologues, in the sugar uptake through the symbiotic membrane of glomeromycotan fungi is indicated together with the substrates of GpMST1 (fructose and putatively xylose are transported weakly). Sumber: http://www.nature.com/nature/journal/v444/n7121/fig_tab/nature05364_F1.html
Hasil-hasil penelitian menunjukkan bahwa efisiensi pupuk fosfat pada tanaman dapat ditingkatkan dengan aplikasi mikorhiza. Aplikasi mikorhiza dapat meningkatkan serapan P tanaman, memperbaiki pertumbuhan tanaman, hasil biomasa tanaman dan hasil biji atau buah.
Sumber: Jlio Alves Cardoso Filho; Eurico Eduardo Pinto de Lemos; Tania Marta Carvalho dos Santos; Luis Carlos Caetano; and Marco Antonio Nogueira. 2008.
BAHAN BACAAN
Chin-hua Ma and Manuel C. Palada. 2008. Fertility Management of the Soil-Rhizosphere System for Efficient Fertilizer Use in Vegetable Production. Asian Vegetable Research and Development Center (AVRDC) the World Vegetable CenterP.O. Box 42, Shanhua, Tainan, Taiwan 74199, 2008-01-16.Glaser, B., Lehmann, J. and W. Zech. 2002. Ameliorating physical and chemical properties of highly weathered soils in the tropics with charcoal a review. Biology and Fertility of Soils 35, 219-230.Ma, C.H. and T.Kalb. 2006. Development of starter solution technology as a balanced fertilization practice in vegetable production. Acta Horticulturae 700: 167-172.McCully, M. 2005. The rhizosphere: the key functional unit in plant/soil/microbial interactions in the field. Implications for the understanding of allelopathic effects. In: Proceedings of the 4th World Congress on Allelopathy, eds. J. Harper, M An, H Wu and J. Kent, Charles Sturt University, Wagga Wagga, NSW, Australia. 21-26 August 2005. International Allelopathy Society. Neumann, G. and V. Rmheld. 2002. Root-induced changes in the availability of nutrients in the rhizosphere. In: Plant Roots The Hidden Half, 3rd ed., Waisel, Y., Eshel, A., and Kafkafi, U., Eds., Marcel Dekker, New York, p.617-649.Palada, M.C. and D.L. Wu. 2005. Influence of rainshelter and irrigation method on yield, water and fertilizer use efficiency of chili pepper. HortScience 40:1143 (abst.).Rmheld, V. and G. Neumann. 2005. The rhizosphere: Definition and perspectives. In: Rhizosphere 2004: A Tribute to Lorenz Hiltner, Hartmann, A. et al., Eds., GSF-Report, Munich, Neuherberg, Germany, p.47-49.Rmheld, V. and G. Neumann. 2006. The Rhizosphere: Contributions of the soil-Root Interface to Sustainable Soil Systems. In: Uphoff, N. et al. (ed.) Biological Approaches to Sustainable Soil Systems. CRC Press, Boca Raton, FL. p.91-107.
Jlio Alves Cardoso Filho; Eurico Eduardo Pinto de Lemos; Tania Marta Carvalho dos Santos; Luis Carlos Caetano; and Marco Antonio Nogueira. 2008. Mycorrhizal dependency of mangaba tree under increasing phosphorus levels. Pesq. agropec. bras.vol.43no.7BrasliaJuly2008