Jurnal Kemurnian Zat
Transcript of Jurnal Kemurnian Zat
-
8/20/2019 Jurnal Kemurnian Zat
1/12
BAB I
PENDAHULUAN
I.1 Latar Belakang
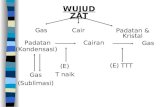
Mencair atau meleleh adalah proses perubahan wujud suatu zat dari padat menjadi cair.
Sebagai contoh, lilin akan mencair atau meleleh ketika dibakar, es yang dibiarkan di udara
terbuka akan mencair. Proses mencair atau meleleh juga sering disebut dengan istilah lain, yaitu
melebur. Suhu ketika suatu zat mulai mencair disebut dengan titik cair, titik leleh, atau titik lebur.
Akan tetapi, yang paling umum digunakan adalah titik lebur.
Titik cair adalah suhu dimana fase cair dan fase padat dalam keadaan setimbang dimana
tekanan luar sama dengan atm. !dealnya titik cair ini berada dalam titik, namun kenyataannya
berada dalam suatu rentang tertentu, biasanya antara ",# $ ",% derajat. &al ini dikarenakan pada
zat padat yang akan dilelehkan tersebut, terdapat zat pengotor, atau pada saat terjadi pencairan
zat padat mengurai karena tidak stabil.
Titik cair ini sangat penting karena merupakan standar untuk'
. Mengidentifikasi senyawa yang tidak diketahui. suatu senyawa yang tidak diketahui dapat
diidentifikasi dengan menentukan titik cairnya. titik cair yang didapat dari percobaan
kemudian dicocokkan dengan literatur yang ada.
(. )ji kemurnian. senyawa yang telah diketahui namanya untuk lebih meyakinkan bahwa
senyawa yang kita miliki benar merupakan senyawa yang dimaksud, bisa dilkukan uji
kemurnian dengan uji titik cair.
#. Menentukan berat molekul dari suatu senyawa. senyawa yang belum diketahui berat
molekulnya namun kita mengetahui titik cairnya, maka untuk mencari berat molekuklnya
bisa dilakukan dengan metode rsat.
-
8/20/2019 Jurnal Kemurnian Zat
2/12
Titik didih adalah suhu dimana terjadi perubahan wujud dari cair menjadi uap *gas+.
ormalnya titik didih zat cair terjadi pada suhu dimana tekanan uapnya adalah atm. Titik didih
juga dapat didefinisikan bahwa titik didih cairan adalah suhu di mana Point fase cair dan uap
berada dalam kesetimbangan dengan satu sama lain pada tekanan tertentu. -leh karena itu, titik
didih adalah suhu dimana tekanan uap cairan sama dengan tekanan diterapkan pada cairan. Titik
didih pada tekanan atmosfer disebut titik didih normal. )ntuk substansi murni pada tekanan P
tertentu, fase stabil adalah fase uap pada temperatur tepat di atas titik didih dan fase cair pada
temperatur langsung di bawah titik didih. aris kesetimbangan cair/uap pada diagram fase zat
murni memberikan titik didih sebagai fungsi dari tekanan. 0adi untuk lebih jelasnya kita akan
bahas lih jelasnya lagi dalam bab/bab berikutnya.
I.2 Rumusan Masalah
Perumusan masalah dalam praktikum kali ini adalah sebagai berikut '
1agaimana cara penentuan titik cair suatu zat2
1agaimana cara penentuan titik didih suatu zat2
I.3 Tujuan
Tujuan dari perumusan masalah dalam praktikum kali ini adalah sebagai berikut '
Mampu mempelajari tentang cara penentuan titik cair suatu zat.
Mampu mempelajari tentang cara penentuan titik didih suatu zat.
-
8/20/2019 Jurnal Kemurnian Zat
3/12
BAB II
TINAUAN PU!TA"A
-
8/20/2019 Jurnal Kemurnian Zat
4/12
II.1 Penentuan T#t#k $a#r !uatu %at
Titik cair didefinisikan sebagai temperatur dimana zat padat berubah menjadi cairan padatekanannya satu atmosfer. Titik cair suatu zat padat tidak mengalami perubahan yang berarti
dengan adanya perubahan tekanan. -leh karena itu tekanan biasanya tidak dilaporkan pada
penentuan titik cair, kecuali kalau perbedaan dengan tekanan normal terlalu besar. Pada
umumnya titik cair senyawa organik mudah diamati sebab temperatur dimana pencairan mulai
terjadi hampir sama dengan temperatur dimana zat telah mencair semuanya. 3ontohnya ' suatu
zat dituliskan dengan range titik cair ((,4/ ((,543 dari pada titik cairnya ((,(43.
0ika zat padat yang diamati tidak murni , maka akan terjadi penyimpangan dari titik cair senyawa
murninya. Penyimpangan itu berupa penurunan titik cair dan perluasan range titik cair.
Misalnya ' suatu asam murni diamati titik cairnya pada temperatur ((,43 $ ((,543
penambahan ("6 zat padat lain akan mengakibatkan perubahan titik cairnya dari temperatur
((,43 $ ((,543 menjadi %43 / 743.
8ata $ rata titik cairnya lebih rendah %43 dan range temperatur akan berubah dari ",#43
jadi 543. Atom/atom unsur alkali terikat dalam struktur terjenjal oleh ikatan logam yang lemah ,
karena setiap atom hanya mempunyai satu elektron ikatan dan bertambah lemah jika jari/jari
bertambah besar. -leh sebab itu titik cair berkurang dari atas ke bawah dalam satu golongan.
Sedangkan pada unsur halogen yang berada dalam keadaan padat berupa kristal terikat oleh
aya 9an der :aals yang lemah. aya ini bertambah jika jari/jari bertambah besar. -leh sebab
itu titik cair bertambah dari atas ke bawah dalam satu golongan. Titik cair bargantung pada
kekuatan relatif dari ikatan. ;alam satu golongan unsur transisi dari atas ke bawah kekuatan
ikatan bartambah, jadi titik cair bertambah.
)nsur 3 dan Si yang mempunyai struktur ko
-
8/20/2019 Jurnal Kemurnian Zat
5/12
;ewasa ini telah banyak alat penguji titik cair yang berkembang dari mulai yang
sederhana sampai yang paling modern. diantaranya adalah'
. =abu kjeldahl, labu yang berisi cairan tangas bersuhu didih tinggi kemudian dipanaskan
diatas pembakar bunsen sambil di aduk/aduk. prinsip utama dari labu kjeldahl ini adalah
dengan menggunakan aliran konlektrothermal, merupakan alat yang lebih modern karena pengamatan sangat mudah
dilakukan. ketika mulai dan berakhirnya semua padatan mencair maka akan terdengar bunyi
alarm. sehingga suhunya dapat di atur, dan pengamatan dilakukan dengan menggunakan kaca
pembesar untuk lebih meyakinkan bahwa semua padatan telah menjadi cair.
II.2 Penentuan T#t#k D#h !uatu %at
Titik didih suatu cairan ialah temperatur pada mana tekanan uap yang meninggalkan
cairan sama dengan tekanan luar. 1ila tekanan uap sama dengan tekanan luar * tekanan yangdikenakan +, mulai terbentuk gelembung/gelembung uap dalam cairan. ?arena tekanan uap
dalam gelembung sama dengan tekanan udara , maka gelembung itu dapat mendorong diri lewat
permukaan dan bergerak ke fase gas di atas cairan, sehingga cairan itu mendidih. Titik didih air
* dalam cairan lain + beraneka ragam menrut tekanan udara.
-
8/20/2019 Jurnal Kemurnian Zat
6/12
;ipergunakan titik didih air kurang dari ""43, karena tekanan udara kurang dari atm.
Saat air berada dalam keadaan mendidih, gelembung/gelembung besar mulai terbentuk dalam
cairan akan naik ke permukaan. 1ila gelembung itu telah terbentuk, cairan yang tadinya
menempati ruang ini didorong dan permukaan cairan pada wadah dipaksa naik untuk melawan
tekanan ke bawah yang ditimbulkan oleh atmosfer. Suhu pada saat cairan mendidih disebut @titik
didih. 0adi titik didih adalah temperatur dimana tekanan uap B tekanan atmosfer.
Penambahan kecepatan panas pada cairan yang mendidih akan mempercepat terbentuknya
gelembung uap air. 3airan pun akan lebih cepat mendidih , tapi suhu didih tidak naik. Titik didih
cairan tergantung pada besarnya tekanan atmosfer. Titik didih pada tekanan atm *CD" torr+
dinamakan sebagai @ titik didih normal @. Pada tekanan yang lebih besar maka titik didihnya juga
lebih tinggi, dan begitu juga sebaliknya. Suhu yang tetap konstan dari cairan yang mendidih
dapat dibuktikan bila kita merebus makanan. :aktu air mendidih , suhu akan tetap selama ada
air disekeliling makanan tersebut berarti selama airnya belum habis makanan tak ada yang
hangus. !tu membuktikan bahwa titik didih berubah dengan berubahnya tekanan.
Titik didih dapat digunakan untuk memperkirakan secara tak langsung berapa kuatnya aya tarik
antara molekul cairan. 3airan yang gaya tarik antar molekulnya kuat , titik didihnya tinggi dan
sebaliknya bila gaya tariknya lemah maka titik didihnya rendah.
Tekanan uap air adalah atm *",#(% kilopascals+ pada "" 4 3 *(( 4 E+, titik didih
normal air. Tekanan uap air adalah #,( kPa *","# atm+ pada suhu (% 4 3 *CC 4 E+, sehingga titik
didih air sebesar #,( kPa adalah (% 4 3. aris kesetimbangan cair/uap pada diagram fasa suatu
zat murni dimulai pada titik tripel *mana padat, cair, dan uap hidup berdampingan dalam
keseimbangan+ dan berakhir pada titik kritis, dimana kepadatan dari fase cair dan uap telah
menjadi sama.
)ntuk tekanan di bawah tekanan tiga/titik atau di atas tekanan kritis/titik, titik didih tidak
berarti. ?arbon dioksida memiliki tekanan tiga titik %, atm *%F kPa+, sehingga karbon
dioksida tidak memiliki titik didih normal. =ihat juga 3ara ;aftar Point 1lank TripleG tekanan
uap. Point didih normal adalah tinggi untuk cairan dengan atraksi antarmolekul yang kuat dan
rendah untuk cairan dengan atraksi antarmolekul yang lemah. &elium memiliki titik didih
terendah normal, 5,( ? */(DF,7 4 3+. 1eberapa titik didih lainnya normal adalah , ? */D( 4
-
8/20/2019 Jurnal Kemurnian Zat
7/12
3+ untuk 3&5, 5%" 4 3 *F5( 4 E+ untuk n/3#"&D(, 5D% 4 3 *(DD7 4 E+ untuk a3l, dan %%%% 4
3 *"."# 4E+ untuk tungsten.
&asil eksperimen 8oult menunjukan bahwa ?enaikan titik didih larutan akan semakin
besar apabila konsentrasi *molal+ dari zat terlarut semakin besar. Titik didih larutan akan lebih
tinggi dari titik didih pelarut murni. &al ini juga diikuti dengan penurunan titik beku pelarut
murni, atau titik beku larutan lebih kecil dibandingkan titik beku pelarutnya.
&asil eksperimen ini disederhanakan dalam gambar berikut.
-
8/20/2019 Jurnal Kemurnian Zat
8/12
;iagram tekanan dan suhu untuk titik didih dan titik beku dari pelarut dan larutan
8oult menyederhanakan ke dalam persamaan
Tb B kb . m
Tb B kenaikan titik didih larutan
kb B tetapan kenaikan titik didih molal pelarut *kenaikan titik didih untuk mol zat dalam """
gram pelarut+
m B molal larutan *molH"" gram pelarut+
Perubahan titik didih atau ITb merupakan selisih dari titik didih larutan dengan titik
didih pelarutnya, seperti persamaan ' ITb B Tb $ TbJ
&al yang berpengaruh pada kenaikan titik didih adalah harga kb dari zat pelarut. ?enaikan tidak
dipengaruhi oleh jenis zat yang terlarut, tapi oleh jumlah partikelHmol terlarut khususnya yang
terkait dengan proses ionisasinya.
)ntuk zat terlarut yang bersifat elektrolit persamaan untuk kenaikan titik didik harus dikalikan
dengan faktor ionisasi larutan, sehingga persamaannya menjadi '
dimana
n B jumlah ion/ion dalam larutan
K B derajat ionisasi
3ontoh jumlah ion untuk beberapa elektrolit'
-
8/20/2019 Jurnal Kemurnian Zat
9/12
&3l L & 3l/, jumlah n B (
&(S-5 L ( & S-5(/, jumlah n B #
P-5 L # & P-5#/, jumlah n B 5
Agar mudah dimengerti kita ambil perhitungan kenaikan titik didih untuk zat non/elektrolit dan
non elektrolit sebagai perbandingannya.
-
8/20/2019 Jurnal Kemurnian Zat
10/12
Sebuah larutan gula 3D&(-D dengan konsentrasi sebesar ". molal, jika pelarutnya air dengan
harga kb B ".%( 43Hmolal. Tentukan titik didih larutan tersebut.
=arutan gula tidak mengalami ionisasi sehingga,
3D&(-D L 3D&(-D
". molal L ". mola
ITb B kb . m
ITb B ".%( . ".
ITb B "."%(o3
;iketahui titik didih air adalah ""43, maka titik didih larutan adalah
ITb B Tb $ Tb"
Tb B "" "."%(Tb B ""."%(
Sekarang coba kita bandingkan dengan zat yang dapat terionisasi ' Sebuah larutan ". molal
&(S-5, zat tersebut merupakan asam kuat dengan derajat ionisasi ; B . jika pelarutnya air, dan
harga kb airB ".%( 43Hmolal. Tentukan titik didih larutan tersebut. Penyelesaian soal ini
ditampilkan pada 1agan berikut.
-
8/20/2019 Jurnal Kemurnian Zat
11/12
1A1 !!!
M>T-;-=-!
!!!. Alat dan 1ahan
!!!.. Alat
Alat/alat yang digunakan dalam praktikum kali ini antara lain ' gelas piala, tabung
reaksi, termometer, jepit tabung, dan korek api
!!!..( 1ahan
1ahan/bahan yang dipakai dalam percobaan penentuan titik cair dan titik didih
suatu zat antara lain ' es batu, garam, asam asetat, dan larutan toluene.
!!!.( Prosedur percobaan
!!!.(. Penentuan Titik 3air Secara =angsung
Siapkan gelas piala 5"" ml dan isi dengan butir/butir es dan garam secukupnya.
Ambil tabung reaksi dan isi dengan asam asetat # ml.
Masukkan tabung tersebut kedalam gelas piala yang berisi butiran es dan aduk asam
tersebut dengan menggunakan termometer perlahan/lahan dan tetap. Setelah cairan dalam tabung membeku, panaskan dengan cara menggenggam tabung
dengan tangan sampai terjadi perbandingan banyaknya cairan dan zat beku ' dan
catatlah suhunya.
!!!.(.( Penentuan Titik ;idih Toulena
0epit tabung reaksi dan termometer #D" o3 sedemikian rupa.
-
8/20/2019 Jurnal Kemurnian Zat
12/12
!si tabung dengan larutan toluene sebanyak # ml.
Panaskan secara hati/hati menggunakan api kecil dan usahakan agar uap tidak keluar
dari tabung, bila perlu cabutlah apinya.
Amati kenaikaan dan bila konstan catatlah suhunya.